近年、種々の慢性疾患に共通の基盤病態として“慢性炎症”が注目されています。自己免疫性疾患に加えて、最近では、肥満や糖尿病などの生活習慣病、癌、神経変性疾患なども慢性炎症の一面を有することが明らかになってきました。従って、慢性炎症の分子機構の解明は、数多くの慢性疾患の治療法や予防法の開発に応用できる可能性があります。しかしながら、慢性炎症の実態は未だ不明の点が多く、慢性炎症を標的とする治療法も確立していません。全ての臓器は、その臓器を特徴付ける“実質細胞”とそれ以外の“間質細胞”から構成されています。間質細胞には、血管構成細胞、免疫担当細胞、組織幹細胞、線維芽細胞など多彩な細胞が含まれ、臓器や病態に特徴的なプロフィールを有しています。このような実質細胞と間質細胞が複雑に相互作用することで慢性炎症が惹起されます。
そこで我々は、“死細胞”、“細胞内代謝”、“医工連携”の3つのキーワードに着目して、慢性炎症の病態解明と医学応用を目指しています。これまでに様々な免疫担当細胞やサイトカインの関与が報告されていますが、慢性炎症を駆動する臓器局所の微小環境はよく分かっていませんでした。我々は、死細胞を核としてマクロファージが集積する“crown-like structure(王冠様構造)”が、肥満(脂肪組織)や非アルコール性脂肪肝炎(肝臓)、急性腎障害(腎臓)に共通して形成され、慢性炎症の起点となることを見出しました。Crown-like structureにおいて、マクロファージは死細胞のクリアランスに働き、この過程で細胞内代謝が変容することで、炎症遷延化に働くよう形質転換すると考えられます。このように、様々な動物モデルを駆使して慢性炎症の病態メカニズムを解明し、臨床研究によりヒトにおける意義を検証して、医工連携による新たな治療戦略の開発に取り組んでいます。
死細胞を起点とする炎症慢性化機構の解明
死細胞センサーMincleによる急性腎障害の慢性化メカニズム
—慢性腎臓病の新たな予防法開発への期待—
J. Exp. Med. 217: e20192230, 2020
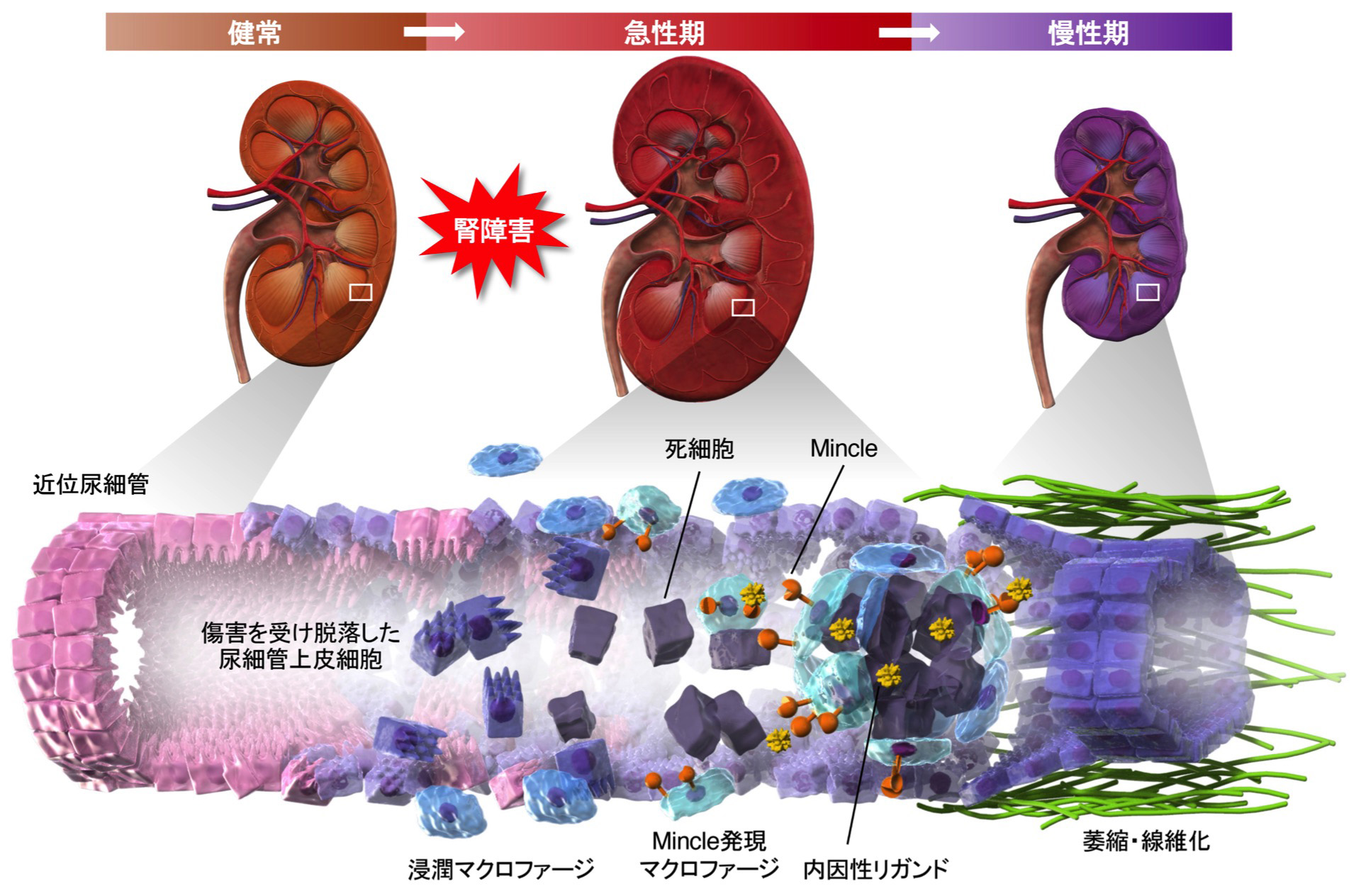
急性腎障害は様々な原因により急激に腎機能が低下する状態で、患者の半数程度は腎機能が一旦回復しますが、中長期的には高い確率で慢性腎臓病に移行することが明らかになり、この病態メカニズムが注目を集めています。一方、Mincle(macrophage-inducible C-type lectin)はマクロファージの細胞膜上に発現する膜タンパクで、従来、結核菌や病原性真菌に対する病原体センサーとして、感染防御に働くことが知られていました。我々は、マウス急性腎障害モデルを用いて、Mincleが壊死尿細管を感知して腎障害の慢性化に働くことを見出しました。この分子メカニズムとして、Mincleが壊死尿細管に蓄積するβ-グルコシルセラミドと遊離コレステロールを認識すると、炎症性サイトカイン産生を増加させるとともに、死細胞のクリアランスを抑制することを示しました。本研究により、急性腎障害から慢性腎臓病への移行メカニズムの一端を明らかにしました。
非アルコール性脂肪肝炎(NASH)の新たな病態メカニズムの解明
—短期間でNASHを発症する疾患モデルの開発を通して—
JCI Insight 2: e92902, 2017
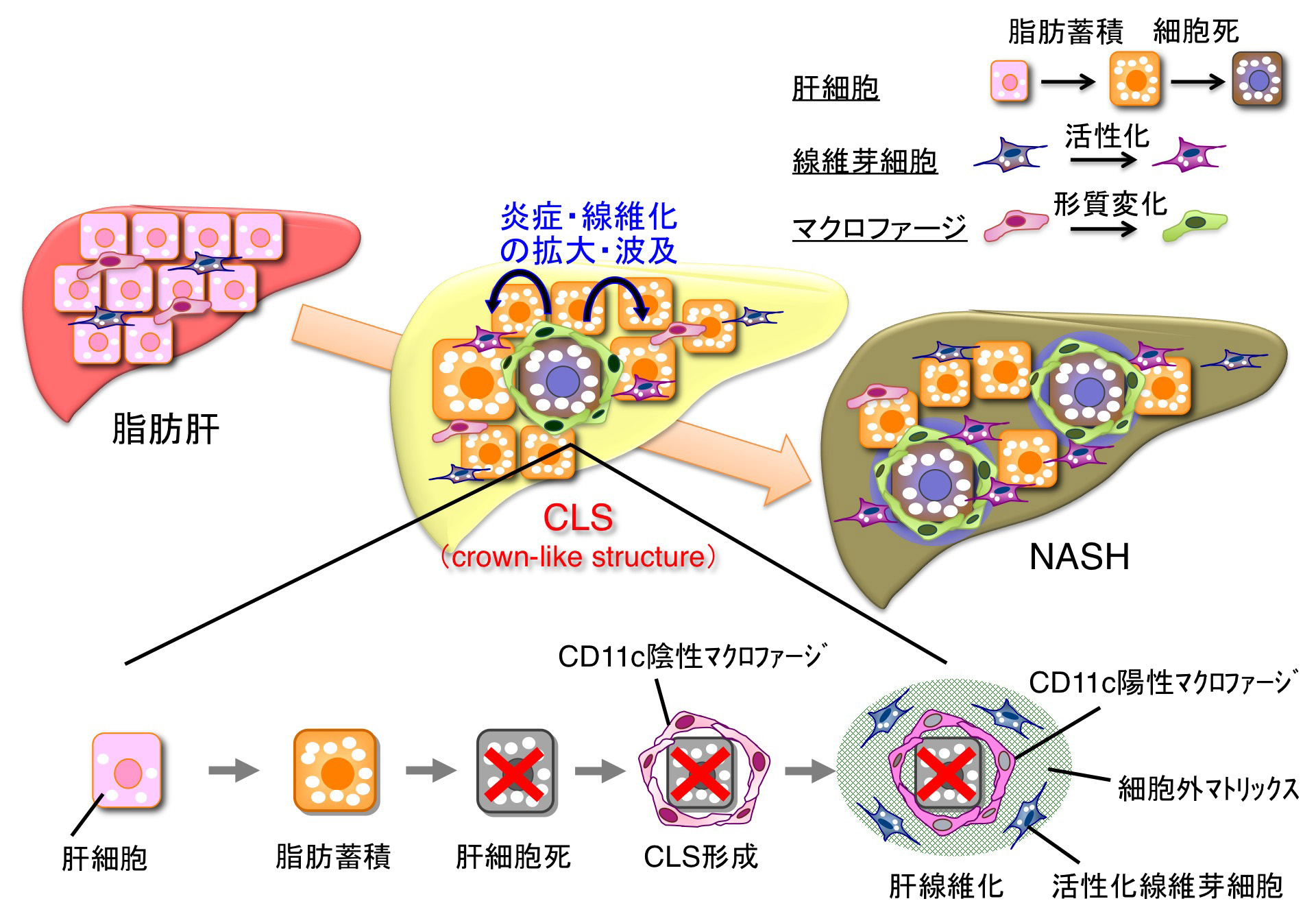
近年、わが国においてもNASHが急増しています。脂肪肝が1,500万症例、その10%程度がNASHに進行し、さらに10%程度が肝硬変や肝細胞癌を発症すると想定されます。しかしながら、どのようにして脂肪肝がNASHに進行するかは未だ明らかになっていません。我々は、短期間でNASHを発症する“誘導性モデル”を新たに開発しました。本疾患モデルを用いることにより、NASHに特異的なマクロファージを同定し、これが特徴的な微小環境(crown-like structure)を形成することで、肝線維化をもたらすことを見出しました。本研究成果は、我が国においても増加が予想されるNASHの発症機序の解明、新規バイオマーカーや治療法の開発に繋がると期待されます。
肥満に伴う脂肪組織の線維化を招く鍵分子を発見
—メタボリックシンドローム治療の新たな分子標的—
Nat. Commun. 5: 4982, 2014
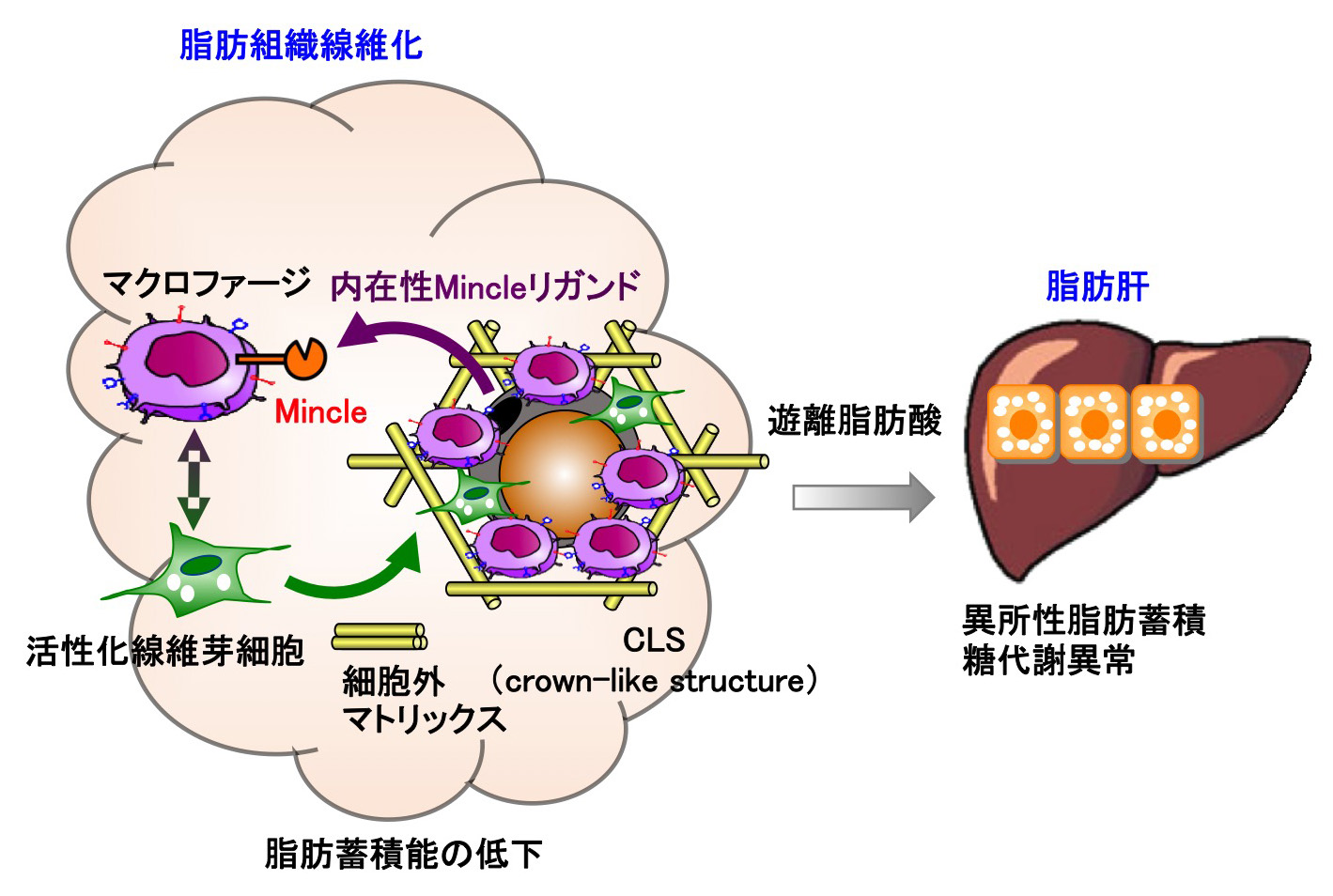
脂肪組織は、余剰エネルギーを中性脂肪として貯蔵する“代謝臓器”としての機能と、ホルモン(アディポカイン)を産生する“内分泌臓器”としての機能を持っています。これまでに、過栄養により誘導される脂肪組織の慢性炎症がアディポカイン産生調節の破綻を招き、メタボリックシンドロームの発症に関わることが知られていました。我々は、脂肪組織炎症の起点となるcrown-like structureに、死細胞センサーのMincleが高発現することを見出しました。Mincleは脂肪組織の線維化を誘導し、脂肪組織の脂肪蓄積能(代謝機能)を障害することで、肝臓への異所性脂肪蓄積(脂肪肝)をもたらします。本研究により、異所性脂肪蓄積を制御する新たな病態メカニズムが明らかになり、Mincleを標的とする新たな治療戦略の開発が期待されます。
細胞内代謝による炎症制御機構の解明
非アルコール性脂肪肝炎(NASH)の新たな病態メカニズムの解明
—クッパー細胞の鉄蓄積が肝線維化を促進する—
iScience 24: 102032, 2021
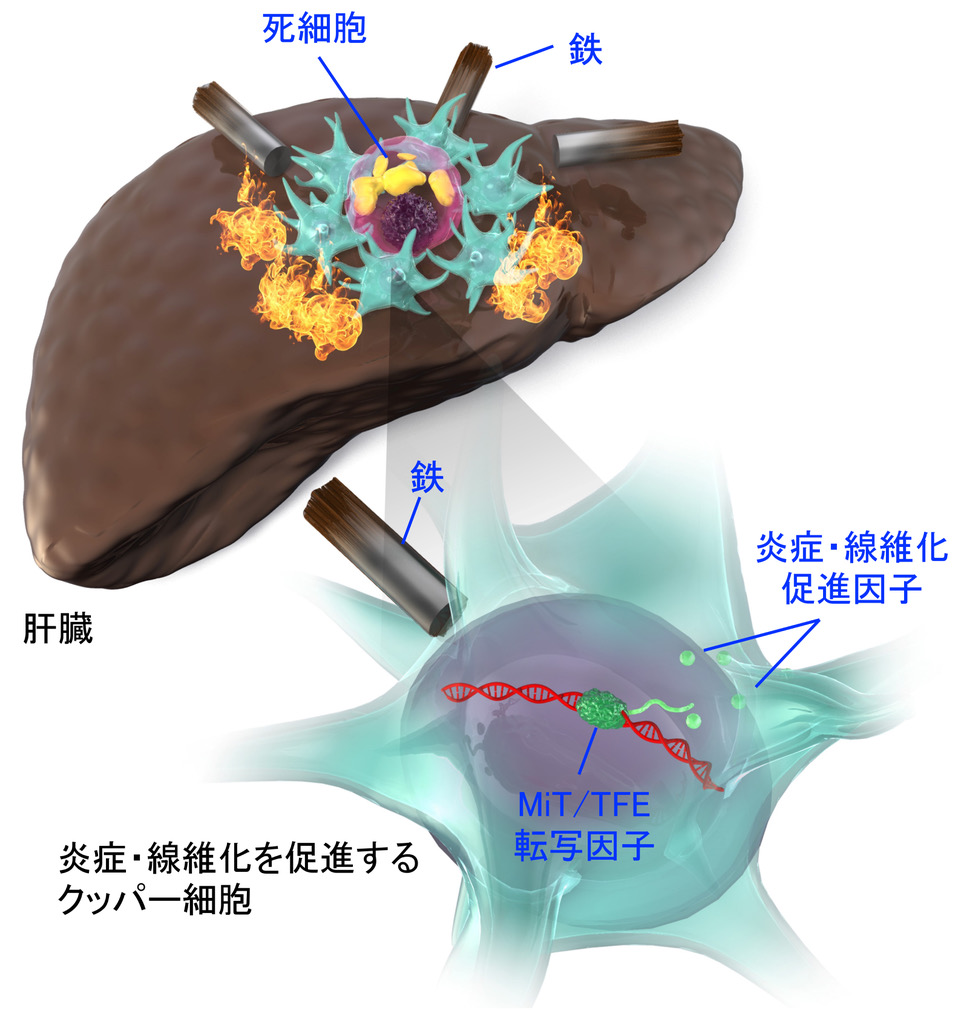
メタボリックシンドロームの病態基盤として全身の「慢性炎症」が注目される一方、炎症・免疫学の領域では、細胞内代謝による免疫担当細胞の活性制御が精力的に研究されています。このように、栄養・代謝と炎症・免疫は表裏一体の関係にあり、新しい学問領域“イムノメタボリズム(免疫代謝)”が世界的な潮流となっています。本研究では、マウスNASHモデルの解析から、細胞内鉄含量の多いマクロファージが肝線維化の促進に働くこと、その機序としてMiT/TFE転写因子が関与することを見出しました。肝臓における鉄蓄積は、NASHの病態メカニズム「multiple parallel hits仮説」にも取り上げられていますが、肝線維化における作用機序や肝臓内の責任細胞については、十分に分かっていませんでした。本研究では、細胞内鉄含量の多寡でマクロファージを分類することにより、最近注目されているマクロファージの多様性に対しても新しい視点を導入しました。
エイコサペンタエン酸の摂取は形質細胞分化を抑制し、全身性エリテマトーデス病態を改善する
Front. Immunol. 12: 650856, 2021
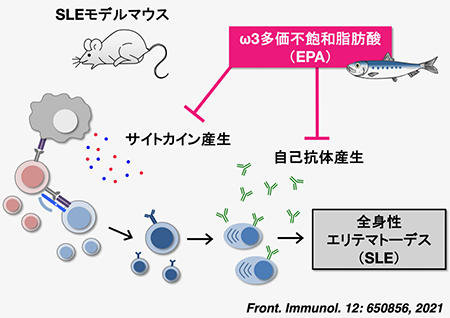
自己免疫疾患は、自己に対して免疫系が過剰に反応することで発症し、多くが難病指定されています。全身性エリテマトーデス(SLE)は代表的な自己免疫疾患であり、国内の推定患者数は6〜10万人に上りますが、根治療法が確立されておらず、病態の発症や促進のメカニズムの全容も未解明です。本研究では、魚油の主成分であるエイコサペンタエン酸(EPA)の経口摂取がSLEモデルマウスにおいて、自己抗体産生や腎糸球体への免疫複合体沈着を抑制し、病態を改善することを明らかにしました。またその作用メカニズムとしてEPAは、B細胞膜の脂質組成を変化させることにより、B細胞から抗体産生細胞である形質細胞への分化を抑制することを見出しました。EPAは日常の食生活に取り入れられること、また高脂血症治療薬として臨床応用されており、安全性が確認されていることから、EPAの摂取はSLEにおける新たな予防法、治療法として有用であると考えられます。
医工連携による生活習慣病の新たな治療戦略の開発
マクロファージへのコレステロール蓄積が肝線維化を促進する:
ー超分子ポリロタキサンを用いた非アルコール性脂肪肝炎治療法の開発へー
J. Exp. Med. 220: e20220681, 2023
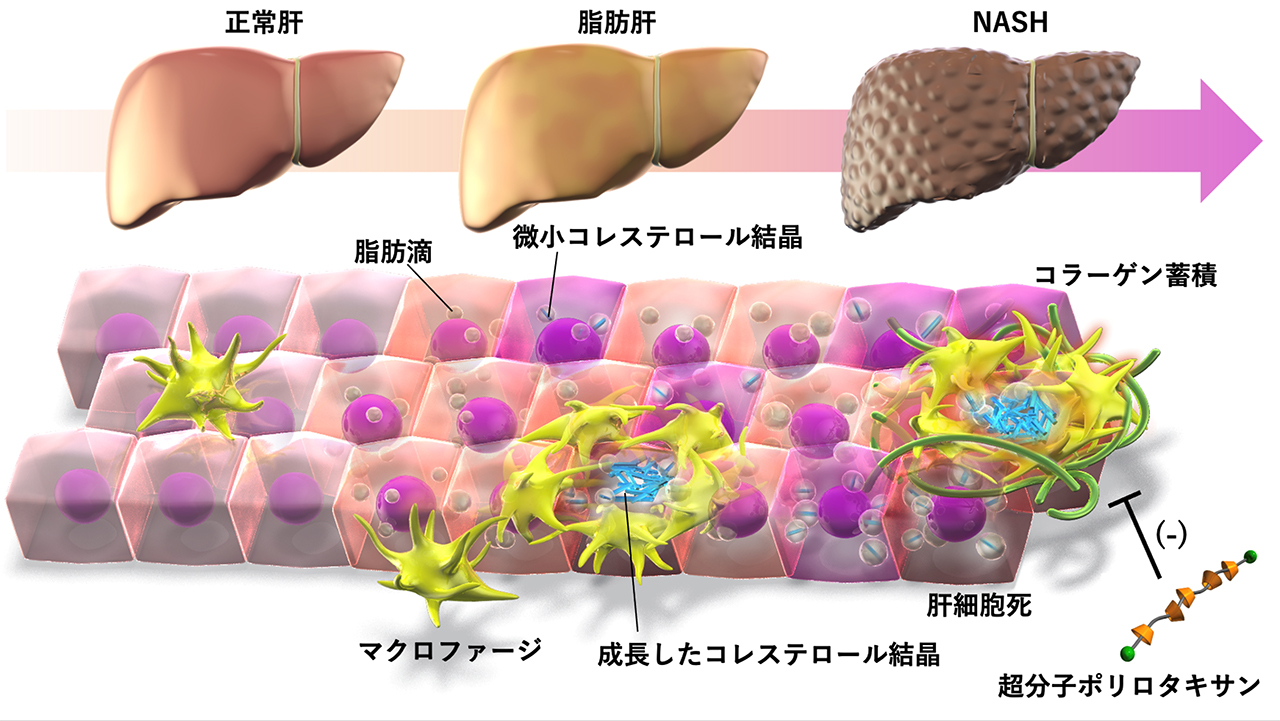
本研究では、非アルコール性脂肪肝炎(NASH)において、マクロファージへのコレステロール蓄積が肝線維化を促進するという新たな病態メカニズムを明らかにしました。世界的な肥満の増加に伴って4人に1人が脂肪肝を発症し、そのうち10〜20%が炎症と線維化を特徴とするNASHに進展します。近年、NASHは肝細胞がんの主要な原因疾患として注目されていますが、未だに有効な治療法は存在しません。予後良好の脂肪肝と異なり、慢性進行性のNASHではコレステロールに代表される細胞障害性脂質が蓄積しますが、従来は主に肝細胞に注目して研究が行われてきました。今回、研究グループは、NASHマウスモデルやヒトNASHサンプルの解析から、死細胞の処理にあたるマクロファージにコレステロールが蓄積することでNASHに特徴的な活性化が誘導され、肝線維化が進行ことを明らかにしました。さらに、独自の超分子ポリロタキサンを合成し、マクロファージ内に蓄積したコレステロールを排泄させることで、NASHマウスモデルにおける肝線維化を抑制することに成功しました。
グルコース応答性ゲルにより自律的にインスリンを放出する人工膵臓デバイスの開発
—血液透析用の中空糸を応用し、ヒト糖尿病治療に向けた性能アップに成功—
Commun. Biol. 3: 313, 2020
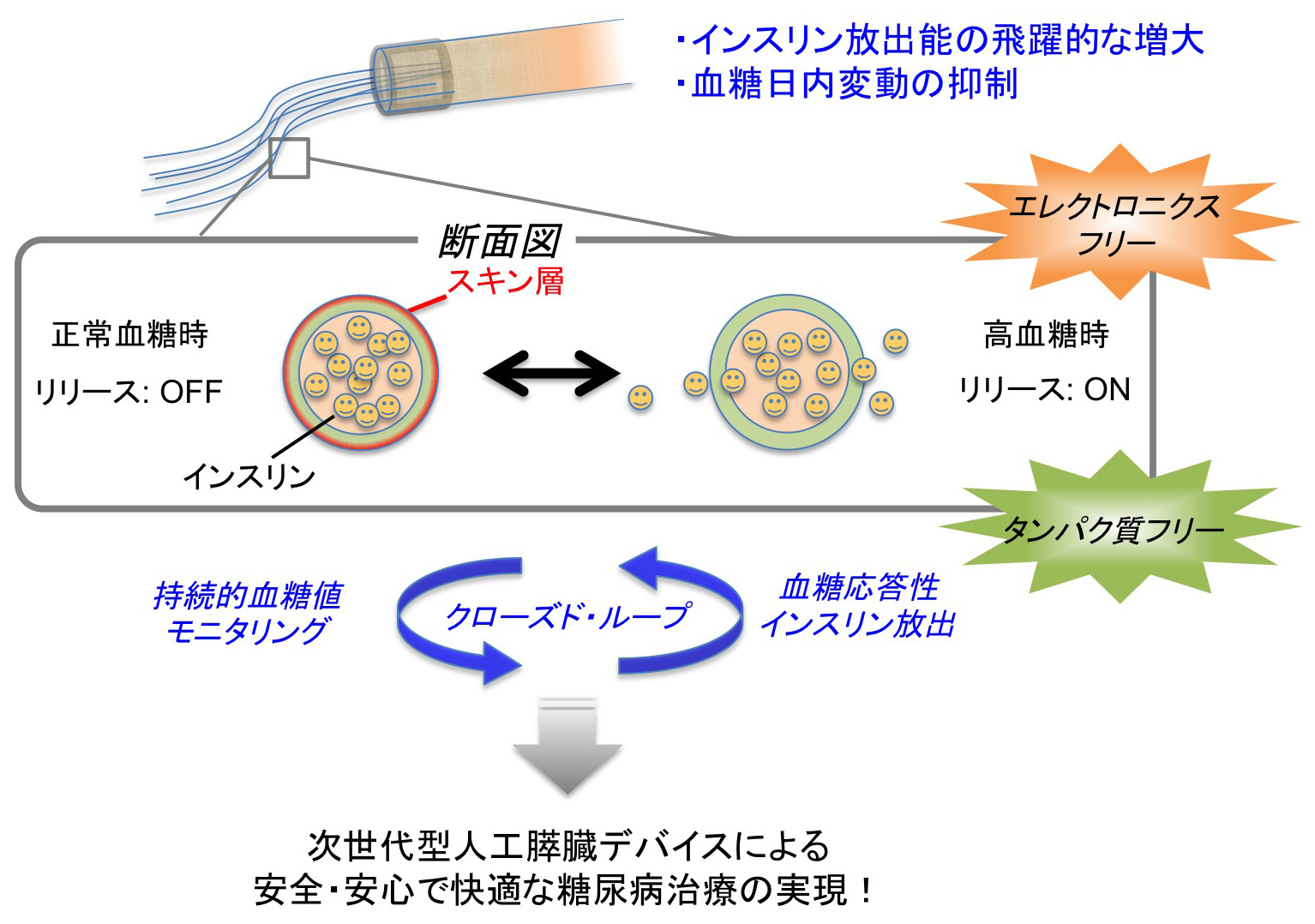
現在、糖尿病治療では、「どのようにして血糖値を下げるか」から「どのようにして糖尿病合併症を予防するか」に主眼がシフトし、低血糖の回避や血糖変動の改善が注目されています。我々は既に、「フェニルボロン酸を主要な成分とする独自の高分子ゲル(グルコース応答性ゲル)」とシリコンカテーテルを組み合わせて、世界初の「エレクトロニクス(機械)フリー」かつ「タンパク質フリー」な仕組みによる人工膵臓デバイスを作製し、マウスを用いて機能実証に成功しました(Sci. Adv. 2017)。今回、グルコース応答性ゲルを血液透析用の中空糸と融合させることにより、インスリン放出効率を飛躍的に向上させるとともに、血糖日内変動に対する抑制効果を新たに見出しました。血糖日内変動は、糖尿病合併症の発症に深く関与するため、本デバイスは単に血糖値を低下させるだけでなく、糖尿病の予後を改善させることが期待されます。
“エレクトロニクスフリー“な人工膵臓デバイスを開発
—血糖値の変化を検知して、自律的にインスリンを放出—
Sci. Adv. 3: eaaq0723, 2017
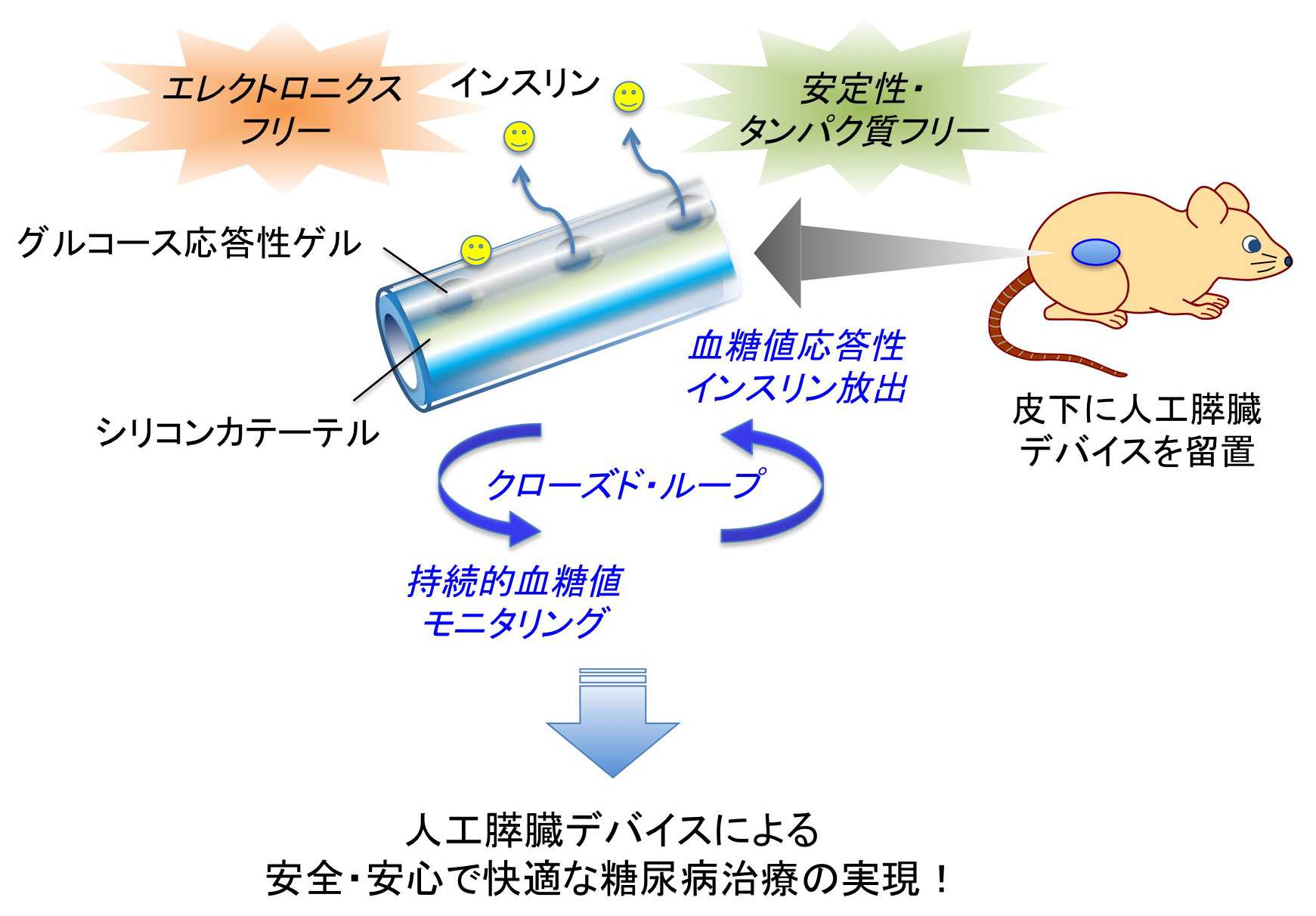
近年、糖尿病に対するインスリン治療においてインスリンポンプの普及が進んでいますが、患者に及ぼす身体的・心理的負担や機械特有の補正・メンテナンスの必要性、医療経済上の問題など多くの課題があります。そこで我々は、タンパク質を一切使用しない、完全合成材料のみによるアプローチを考案しました。即ち、グルコースと可逆的に結合するボロン酸を高分子ゲルに化学的に組み込み、さらにこれを一本のカテーテルに搭載することで、皮下挿入が容易で、かつ「人工膵臓」機能を発揮する自律型のインスリン供給デバイスの開発に成功しました。本研究は、世界初の「エレクトロニクスフリー」かつ「タンパク質フリー」なアプローチによる人工膵臓デバイスの糖尿病治療機能を、動物実験段階ではあるものの高いレベルで実証したものです。

