ゲノム動態制御分野(分子機能薬学)
メンバー

研究内容
ゲノムDNAは、環境中の紫外線や種々の化合物、あるいは細胞自身の代謝産物などにより、絶えず損傷を受け続けています。DNA損傷は転写や複製などの正常なDNA代謝を妨げて、細胞死の原因となり、また、染色体異常や突然変異を誘発して、癌化や老化の原因となると考えられます。しかし、健常人の細胞は、細胞周期チェックポイントやDNA修復機構、さらには、損傷乗り越えDNA複製機構など、多重のゲノム動態制御機構を備えており、DNA損傷による弊害は未然に防がれています。一方で、某かのゲノム動態制御機構に異常があるためにゲノムの安定性が損なわれ、高頻度発癌や早期老化、その他の様々な生理機能の異常を呈する遺伝疾患が多数知られています。当研究室では、ゲノム不安定性遺伝疾患の原因機構の解明を通じて、ヒト細胞のゲノム動態制御機構を包括的に明らかにし、癌を始めとするゲノムの不安定性を伴う疾患や老化の理解に資することを目的として以下のような研究を行っています。
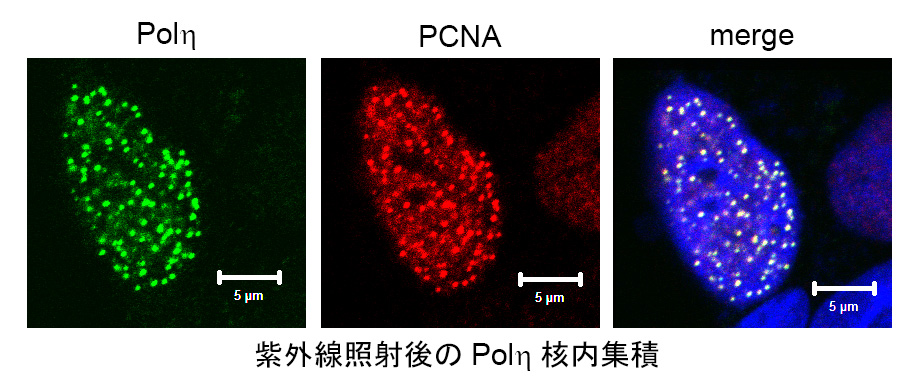
- 損傷乗り越えDNA複製(TLS: translesion synthesis)の分子機構及びその制御機構の解明 ゲノム不安定性遺伝疾患の1つである色素性乾皮症バリアント群(XP-V)は紫外線に高い感受性を示し、高頻度で皮膚癌を発症します。我々のグループではXP-Vの原因遺伝子産物が、紫外線損傷を鋳型としてDNA損傷を乗り越えてDNA複製を行うDNAポリメラーゼ・イータ(Polη)であることを発見しました。これ以降、様々な生物種で一群の類似のDNAポリメラーゼが同定され、TLS研究は大きく発展してきました。我々は、ヒトPolηが、紫外線損傷の正確な乗り越え複製を担う機能構造基盤を明らかにし、一方で、誤りがちなDNA合成酵素としてゲノムの多様化に寄与することなどを明らかにしてきました。また、Polηは紫外線損傷に対する正確なTLSを担う一方で、誤りがちなDNAポリメラーゼであるため、生体内で厳密な制御を受けると考えられます。また、ヒト細胞は、複数のTLSポリメラーゼを備えていますがそれらを使い分ける機構もまだほとんど明らかになっていません。我々は、Polηを中心としたタンパク質間相互作用の解析などからTLSの制御機構の研究を進めています。近年は複製のスライディングクランプPCNAのユビキチン化修飾とTLSポリメラーゼの相互作用に着目し、解析を行っています。
- ヒト細胞における未解明のDNA損傷トレランス機構の解明 DNA上の損傷によって生じるDNA複製阻害を回避する機構をDNA損傷トレランスと呼びます。TLSはDNA損傷トレランスの1つの経路です。細胞内にはTLS以外にもDNA複製阻害を回避するメカニズムがあると考えられていますが、ヒト細胞ではほとんど明らかになっていません。我々はヒト細胞内におけるTLS以外の未解明のDNA損傷トレランスのメカニズムの解析に取り組んでいます。
- DNA損傷対応機構間の時空間的連携機構の解明 細胞は、DNA損傷に応答して細胞周期を停止する細胞周期チェックポイント機構、DNA修復機構、DNA損傷トレランス機構など、多重のDNA損傷対応機構を備えています。それらの相互の連携機構を明らかにしたいと考えています。特にTLSは、複製と修復をカップリングする機構と位置付けられます。また、TLSはチェックポイントのON/OFFと連携しているはずです。さらに、それらの連携様式は、細胞の種類や組織の違いなどにより異なる可能性が考えられます。それらの時空間的な多様性を明らかにしていくことで、様々なゲノム不安定性疾患における多様な臨床症状の理解に繋がると考えています。
- DNA損傷トレランス機構をターゲットとした創薬研究 Polηが抗癌剤であるシスプラチンで生じるDNA損傷を乗り越える性質を持つことに着目し、癌細胞のシスプラチン耐性を緩和する薬剤のスクリーニングを行っています。基礎研究の成果を創薬に生かすことを常に念頭においています。
研究業績
- Sugimoto Y, Masuda Y, Iwai S, Miyake Y, Kanao R, Masutani C. Novel mechanisms for the removal of strong replication-blocking HMCES- and thiazolidine-DNA adducts in humans. Nucleic Acids Res. gkad246, 2023.
- Kanao R, Kawai H, Taniguchi T, Takata M, and Masutani C. RFWD3 and translesion DNA polymerases contribute to PCNA modification–dependent DNA damage tolerance. Life Sci Alliance 5: e202201584, 2022.
- Masuda Y, Saeki Y, Arai N, Kawai H, Kukimoto I, Tanaka K, Masutani C. Stepwise multipolyubiquitination of p53 by the E6AP-E6 ubiquitin ligase complex. J Biol Chem 294: 14860-14875, 2019.
- Masuda Y, Kanao R, Kawai H, Kukimoto I, Masutani C. Preferential digestion of PCNA-ubiquitin and p53-ubiquitin linkages by USP7 to remove polyubiquitin chains from substrates. J Biol Chem. 294: 4177-4187, 2019.
- Masuda Y, Mitsuyuki S, Kanao R, Hishiki A, Hashimoto H, Masutani C. Regulation of HLTF-mediated PCNA polyubiquitination by RFC and PCNA monoubiquitination levels determines choice of damage tolerance pathway. Nucleic Acids Res. 46: 11340-11356, 2018.
- Kashiwaba S, Kanao R, Masuda Y, Kusumoto-Matsuo R, Hanaoka F, Masutani C. USP7 is a suppressor of PCNA ubiquitination and oxidative-stress-induced mutagenesis in human cells. Cell Reports, 13: 2072-2080, 2015.
- Masuda Y, Kanao R, Kaji K, Ohmori H, Hanaoka F, Masutani C. Different types of interaction between PCNA and PIP boxes contribute to distinct cellular functions of Y-family DNA polymerases. Nucleic Acids Research, 43: 7898-7910, 2015.
- Kanao R, Masuda Y, Deguchi S, Yumoto-Sugimoto M, Hanaoka F, Masutani C. Relevance of Simultaneous Mono-Ubiquitinations of Multiple Units of PCNA Homo-Trimers in DNA Damage Tolerance. PLoS One, 10(2):e0118775, 2015.
- Masutani C, Kusumoto R, Yamada A, Dohmae N, Yokoi M, Yuasa M, Araki M, Iwai S, Takio K, Hanaoka F. The XPV (xeroderma pigmentosum variant) gene encodes human DNA polymerase eta. Nature, 399: 700-704, 1999.
- Masutani C, Araki M, Yamada A, Kusumoto R, Nogimori T, Maekawa T, Iwai S, Hanaoka F. Xeroderma pigmentosum variant (XP-V) correcting protein from HeLa cells has a thymine dimer bypass DNA polymerase activity. EMBO J. 18: 3491-3501, 1999.
- Masuda Y, Masutani C. Spatiotemporal regulation of PCNA ubiquitination in damage tolerance pathways. Crit Rev Biochem Mol Biol. 54: 418-442, 2019.
- Kanao R, Masutani C. Regulation of DNA damage tolerance in mammalian cells by post-translational modifications of PCNA. Mutat Res Fund Mol Mech Mutagen 803-805: 82-88, 2017.
- Masuda Y, Hanaoka, F, Masutani, C. Translesion DNA Synthesis and Damage Tolerance Pathways. Fumio Hanaoka • Kaoru Sugasawa Editors, DNA Replication, Recombination, and Repair, Molecular Mechanisms and Pathology. Chapter 11 249-304, Springer Japan 2016
- Masutani C, Hanaoka F, Ahmad SI. Xeroderma pigmentosum variant: its product and biological roles. Adv. Exp. Med. Biol., 637: 93-102, 2008.



