分子代謝医学分野(免疫代謝学)

教員紹介
ラボメンバー

研究内容
分子代謝医学分野は、平成27年7月1日に名古屋大学環境医学研究所(ストレス受容・応答研究部門)に発足しました。基礎研究と臨床研究を繋ぐ立ち位置で、生活習慣病の病態解明や新しい治療法の開発に貢献したいと考えています。
ライフスタイルの欧米化に伴って、我が国においても肥満が増加し、メタボリックシンドロームや様々な生活習慣病の誘因となっています。生活習慣病は遺伝素因と環境因子の相互作用により発症する代表的な多因子疾患ですが、我々を取り巻く環境の変化と生体のストレス応答が大きく関わっています。このメカニズムを明らかにするためには、1つの分子や1つの細胞に注目するだけでなく、各臓器を構成する多彩な細胞の相互作用や神経系、内分泌代謝系、免疫系を介する複雑な臓器間ネットワークを理解する必要があります。このような、細胞内、細胞間、臓器間の各階層におけるメカニズムが複雑に絡み合って形成される生活習慣病を解くキーワードとして、私たちは「慢性炎症」に注目しています。また、様々な環境変化の中で、私たちは、特に「栄養」に興味を持っています。即ち、過栄養や栄養飢餓といった栄養の“量”の変化に加えて、動物性の飽和脂肪酸や魚油に多く含まれるω-3多価不飽和脂肪酸、アミノ酸などの栄養の“質”の変化が、どのようにして“慢性炎症”に繋がるのかを明らかにしたいと考えています。
分子代謝医学分野では、医学部、農学部、薬学部など多彩なバックグラウンドを有するメンバーが集まり、各々の特長を活かして自由闊達に切磋琢磨することを重視しています。このような背景を踏まえて、最近、「医工連携」による生活習慣病に対する新しい治療戦略の開発にも取り組んでいます。臨床応用に繋がる“夢”のある基礎医学研究に興味のある方は、是非ご参加下さい。
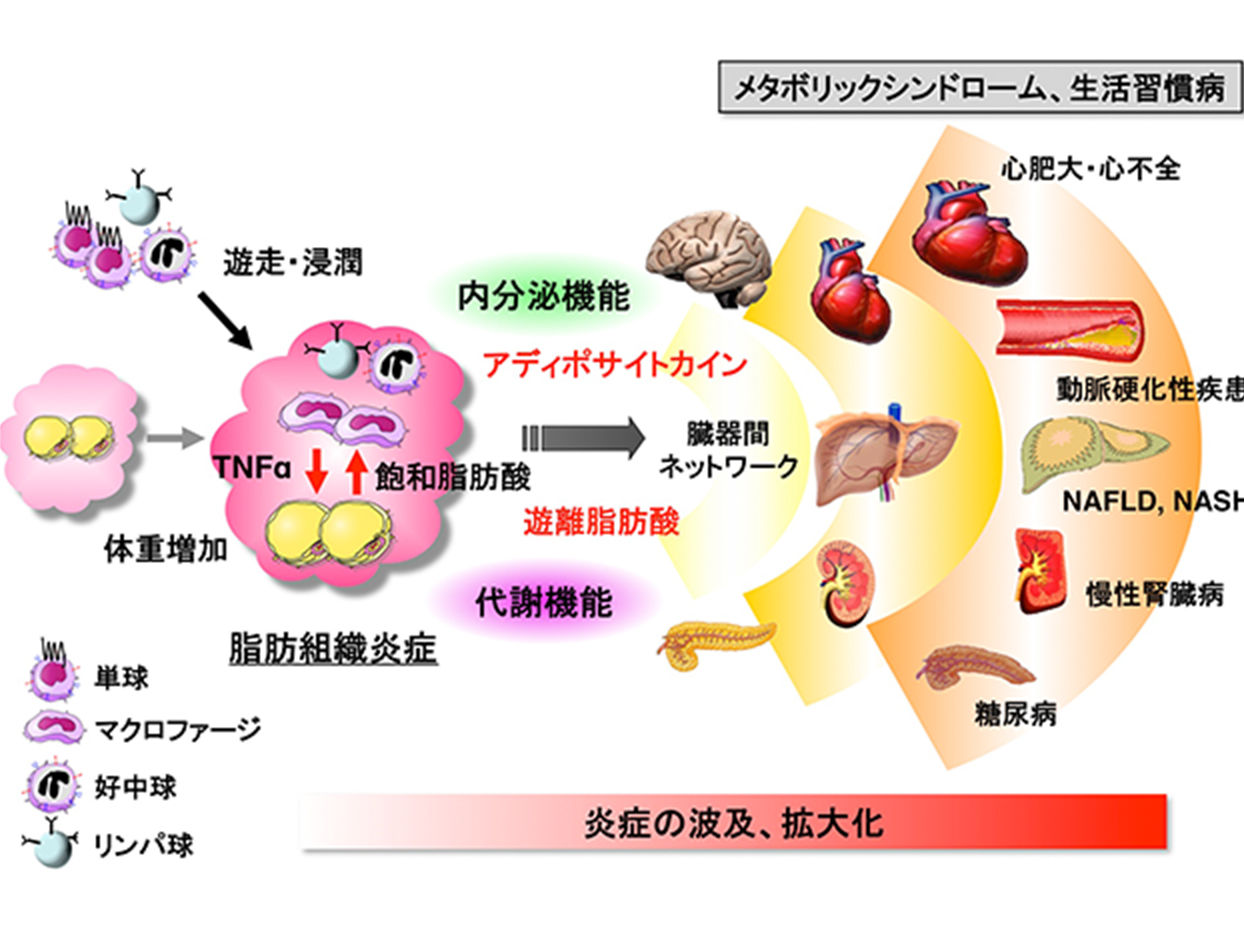 図1 脂肪組織を起点とする慢性炎症の波及、拡大と生活習慣病
図1 脂肪組織を起点とする慢性炎症の波及、拡大と生活習慣病
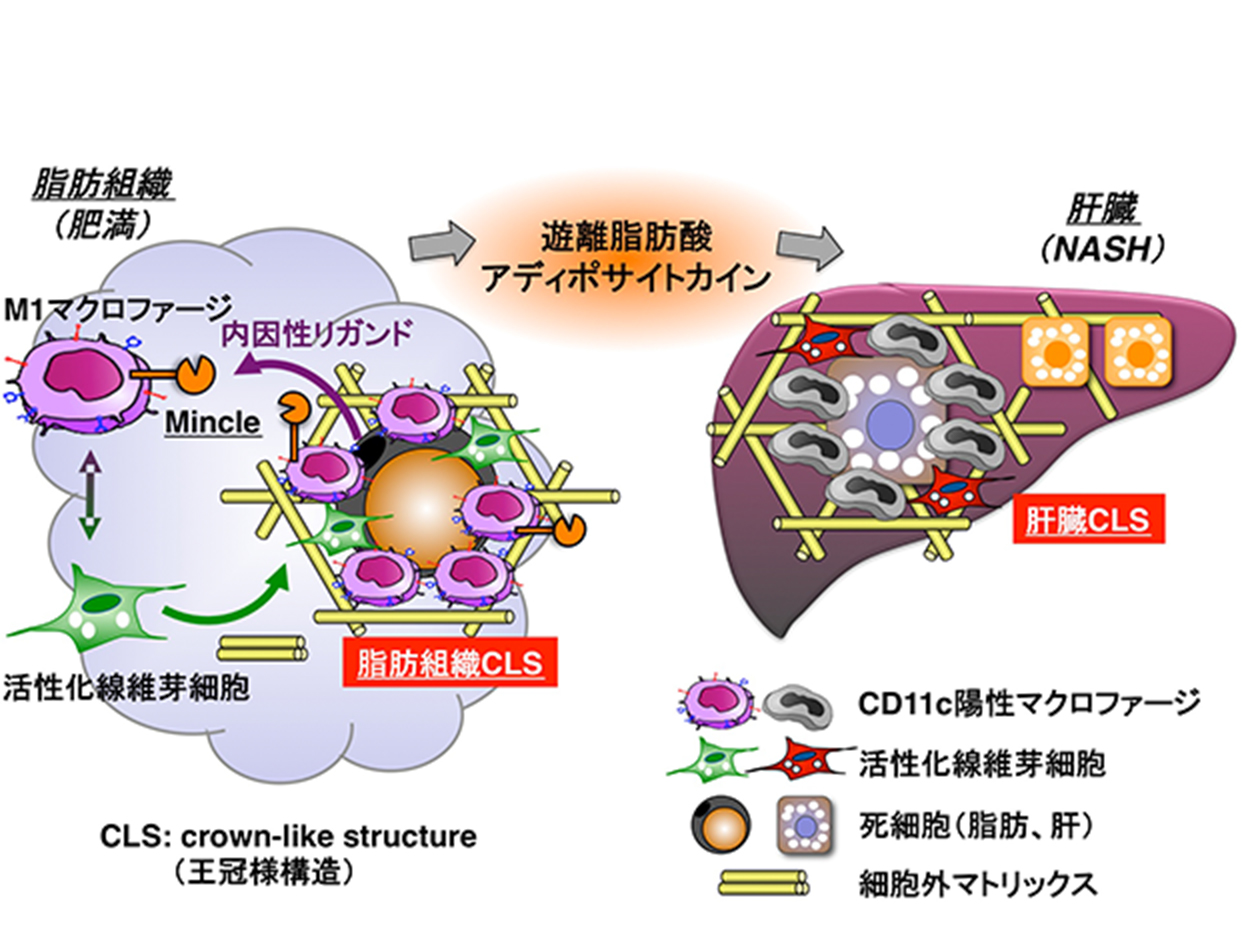 図2 細胞死を起点とする代謝性組織リモデリングと生活習慣病
図2 細胞死を起点とする代謝性組織リモデリングと生活習慣病
研究業績
- M. Itoh, A. Tamura, S. Kanai, M. Tanaka, Y. Kanamori, I. Shirakawa, A. Ito, Y. Oka, I. Hidaka, T. Takami, Y. Honda, M. Maeda, Y. Saito, Y. Murata, T. Matozaki, A. Nakajima, Y. Kataoka, T. Ogi, Y. Ogawa, T. Suganami. Lysosomal cholesterol overload triggers macrophage phenotypic changes and promotes liver fibrosis in nonalcoholic steatohepatitis. J. Exp. Med. 220: e20220681, 2023.
- T. Inoue, B. Fu, M. Nishio, M. Tanaka, H. Kato, M. Tanaka, M. Itoh, H. Yamakage, K. Ochi, A. Ito, Y. Shiraki, S. Saito, M. Ihara, H. Nishimura, A. Kawamoto, S. Inoue, K. Saeki, A. Enomoto, T. Suganami, N. Satoh-Asahara. Novel therapeutic potentials of Taxifolin for obesity-induced hepatic steatosis, fibrogenesis, and tumorigenesis. Nutrients 15: 350, 2023.
- A. Kobayashi, A. Ito, I. Shirakawa, A. Tamura, S. Tomono, H. Shindou, P. Niklas Hedde, M. Tanaka, N. Tsuboi, T. Ishimoto, S. Akashi-Takamura, S. Maruyama, T. Suganami. Dietary supplementation with eicosapentaenoic acid inhibits plasma cell differentiation and attenuates lupus autoimmunity. Front. Immunol. 12: 650856, 2021.
- N. Yoshioka, M. Tanaka, K. Ochi, A. Watanabe, K. Ono, M. Sawada, T. Ogi, M. Itoh, A. Ito, Y. Shiraki, A. Enomoto, M. Ishigami, M. Fujishiro, Y. Ogawa, T. Suganami. The sodium-glucose cotransporter-2 inhibitor Tofogliflozin prevents the progression of nonalcoholic steatohepatitis–associated liver tumors in a novel murine model. Biomed. Pharmacother. 140: 111738, 2021.
- K. Kurita, H. Ohta, I. Shirakawa, M. Tanaka, Y. Kitaura, Y. Iwasaki, T. Matsuzaka, H. Shimano, S. Aoe, H. Arima, Y. Ogawa, A. Ito, T. Suganami. Macrophages rely on extracellular serine to suppress aberrant cytokine production. Sci Rep. 11: 11137, 2021.
- Y. Kanamori, M. Tanaka, M. Itoh, K. Ochi, A. Ito, I. Hidaka, I. Sakaida, Y. Ogawa, T. Suganami. Iron-rich Kupffer cells exhibit phenotypic changes during the development of liver fibrosis in NASH. iScience 24: 102032, 2021.
- M. Tanaka, M. Saka-Tanaka, K. Ochi, K. Fujieda, Y. Sugiura, T. Miyamoto, H. Kohda, A. Ito, T. Miyazawa, A. Matsumoto, S. Aoe, Y. Miyamoto, N. Tsuboi, S. Maruyama, M. Suematsu, S. Yamasaki, Y. Ogawa, T. Suganami. C-type lectin Mincle mediates cell death–triggered sustained inflammation in acute kidney injury. J. Exp. Med. 217: e20192230, 2020.
- A. Matsumoto, H. Kuwata, S. Kimura, H. Matsumoto, K. Ochi, Y. Moro-oka, A. Watanabe, H. Yamada, H. Ishii, T. Miyazawa, S. Chen, T. Baba, H. Yoshida, T. Nakamura, H. Inoue, Y. Ogawa, M. Tanaka, Y. Miyahara, T. Suganami. Hollow fiber-combined glucose-responsive gel technology as an in vivo electronics-free insulin delivery system. Commun. Biol. 3: 313, 2020.
- A. Matsumoto, M. Tanaka, H. Matsumoto, K. Ochi, Y. Moro-oka, H. Kuwata, H. Yamada, I. Shirakawa, T. Miyazawa, H. Ishii, K. Kataoka, Y. Ogawa, Y. Miyahara, T. Suganami. Synthetic “smart-gel” provides glucose-responsive insulin delivery in diabetic mice. Sci. Adv. 3: eaaq0723, 2017. (cover picture of the issue)
- M. Itoh, T. Suganami, H. Kato, S. Kanai, I. Shirakawa, T. Sakai, T. Goto, M. Asakawa, I. Hidaka, H. Sakugawa, K. Ohnishi, Y. Komohara, K. Asano, I. Sakaida, M. Tanaka, Y. Ogawa. CD11c-positive resident macrophages drive hepatocyte death-triggered liver fibrosis in a murine model of non-alcoholic steatohepatitis. JCI Insight 2: e92902, 2017.
- M. Tanaka, K. Ikeda, T. Suganami, C. Komiya, K. Ochi, I. Shirakawa, M. Hamaguchi, S. Nishimura, I. Manabe, T. Matsuda, K. Kimura, H. Inoue, Y. Inagaki, S. Aoe, S. Yamasaki, Y. Ogawa. Macrophage-inducible C-type lectin underlies obesity-induced adipose tissue fibrosis. Nat. Commun. 5: 4982, 2014.
著書・総説
- 菅波孝祥、田中 都、伊藤美智子(編集) 実験医学別冊 もっとよくわかる! 「線維化と疾患」 羊土社 39, 2023.
- 菅波孝祥、田中 都 「脂肪細胞由来リガンドによるマクロファージ活性化」 実験医学(増刊号) 「シン・マクロファージ」 羊土社 40: 37-43, 2022.
- 菅波孝祥、田中 都、小川佳宏 「脂肪組織の線維化メカニズム」 実験医学(増刊号) 「個人差の理解へ向かう肥満症研究」 羊土社 39: 26-31, 2021.
- 菅波孝祥、柳田素子、武田憲彦(編集) 実験医学(増刊号) 「線維化 慢性疾患のキープロセス 多彩な間質細胞が織りなす組織リモデリング“fibrosis”の理解」 羊土社 38, 2020.
- 菅波孝祥(企画) 特集「脂肪の量と質を「制御」する〜脂肪毒性の新たなメカニズムを理解しメタボ克服に挑む」 実験医学 36 羊土社 2018.
- 菅波孝祥、田中 都、伊藤綾香、小川佳宏 「メタボリックシンドロームとリポクオリティ」 実験医学(増刊号) 「脂質が支えるバイオロジー」 羊土社 34:135-141, 2016.





